“面对申请人与日俱增的沟通交流申请,CDE的沟通交流越来越专业、规范和透明。未来,希望CDE加强审评人员的能力建设,以更好应对申请人的沟通交流需求;同时,申请人的科学专业素养和交流能力也需要不断提高,使得交流更加高效。”
撰文

周芳
和铂医药注册事务部总监

杨晓红
创胜医药药政事务部副总裁

郭建平
以明生物注册事务部总监
沟通交流,系指在药物研发与注册申请技术审评过程中,申请人与CDE审评团队,就现行药物研发与技术指南不能涵盖的关键技术等问题所进行的沟通交流。申请人通过与CDE有效的沟通交流,可以在药品研发上市过程中降低和规避药物研发风险,切实提高药品研发注册上市的成功率,加速药品上市以满足患者的临床需求。故而对申请人而言,系统了解沟通交流相关各项政策法规、技术要求,充分利用相应渠道,依法依规地与CDE进行沟通交流,对申请人来说至关重要。


沟通交流会议
根据2020年CDE发布《药物研发与技术审评沟通交流管理办法》,沟通交流会议类型包括Ⅰ类、Ⅱ类和Ⅲ类会议,以就关键阶段重大问题进行沟通交流(见下表)。
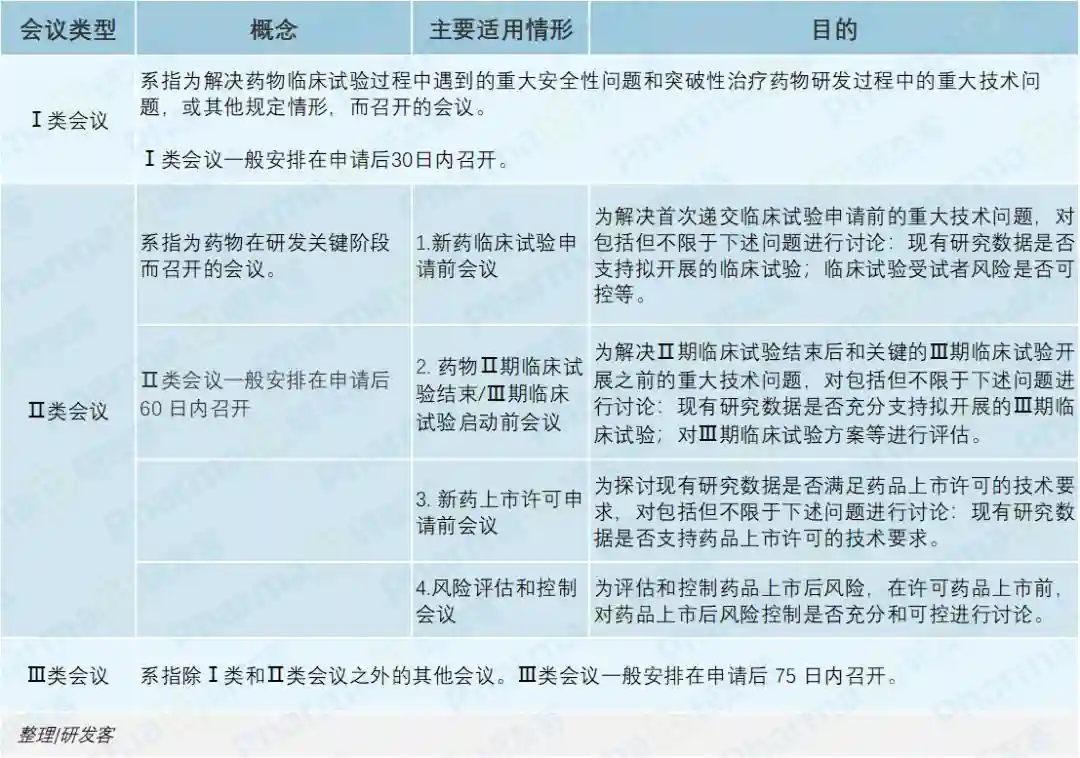
最近发布的《药物研发与技术审评沟通交流管理办法》有效加快了中国参与国际多中心临床试验的进度。例如,《药物研发与技术审评沟通交流管理办法》的第七条中提到了“对于技术指南明确、药物临床试验有成熟研究经验,申请人能够保障申报资料质量的,或国际同步研发的国际多中心临床试验申请,在监管体系完善的国家和/或地区已获准实施临床试验的,申请人可不经沟通交流直接提出临床试验申请。”
在沟通交流时,笔者认为,申请人需要特别留意的地方主要有以下几个方面:
1.《药物研发与技术审评沟通交流管理办法》规定了“申请附条件批准和/或适用优先审评审批程序的,应与CDE沟通交流确认后,方可向国家药品监督管理局递交药品上市许可申请。”这类沟通交流,作为提交注册申请的程序,需要获得沟通交流会是否同意纳入附条件批准和/或优先审评审批程序的明确结论。完成沟通交流并取得明确结论后,申请人填写药品注册申请表,方可勾选“附条件批准”和/或“优先审评审批”。
2.沟通交流会议,如未获得否同意纳入附条件批准和/或优先审评审批程序的明确结论,申请人应积极沟通,直至取得明确的书面意见。
企业面临的机遇及挑战
经过十余年的演变,我国药品注册申请过程中的沟通交流在实践中不断优化,已逐渐成为申请人在研发过程中必不可少的关键考量因素。根据CDE近年来发布的年度审评报告和公开信息,各类别的沟通交流申请数量一直逐年递增。
2016~2020年接收沟通交流申请和一般性技术问题咨询具体情况见下表:

2020年,CDE组织申请人与CDE审评团队之间的沟通交流5,600余次。2020年各类沟通交流会议申请及办理情况如下:
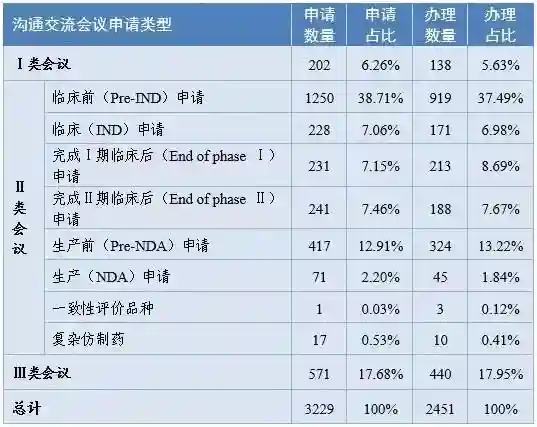
注:2020年办理的申请中,有部分为2019年提交的申请。
这一方面与新药受理和审评审批的增长相呼应,另一方面也反映了申请人在药品开发过程中及时获得监管机构指导的迫切需求。在沟通交流方面,企业仍面临着一些挑战,希望能在监管机构的指引下,在同行共同努力下不断提高沟通交流的质量和效率。
另外,对申请人而言,为了提高沟通效率,应该利用好“申请人之窗一般性技术咨询”的沟通交流机制。尤其是与产品受理号链接的项目技术咨询,可充分阐明相关技术问题和提供支持性数据,并请CDE根据科学性评估给予明确答复。同时,CDE如能及时予以回复(技术类问题15个工作日内,非技术性问题10个工作日内),也将减少申办方为获得官方确认而递交补充申请的情况,一定程度上避免审评资源的不必要占用。
3.临床试验方案重大修订的沟通交流
《药品注册管理办法》将临床研究期间的变更,按照对受试者安全性的影响分为两级管理,评估可能增加受试者安全性风险的应当提出补充申请。按照国际惯例,临床试验方案的重大变更,除了可能影响受试者的安全性之外,还包括方案内容的实质性变更(如人群、统计假设等),可能对临床试验的科学性、安全和有效性产生重大影响。
在实践中,仅影响受试者安全的方案变更,可以通过补充申请递交和受理,而其他重大方案变更尚无正式申报路径,申请人只能通过沟通交流的方式与CDE进行确认,但Ⅲ类会议75个工作日比补充申请时限更长,很难满足方案修订和实施的时限需求。
4.进一步加强不同部门间沟通交流以加快药品审评审批
药品审评审批过程涉及多个部门,而不同部门间对相关技术要求可能会出现理解不一致,可能导致不同部门对其他部门的技术建议/结论产生不同意见的情况;因部门间对技术要求理解不一致导致审评程序中止、审批时限延迟的情况虽然不多,但一旦发生,对注册申请及申请人都会造成一定影响。
对沟通交流的展望
为推动创新药品开发,帮助企业解决研发过程中的问题,近年来国家药监局和CDE也进行多方面探索,其中包括药品审评检查长三角分中心(简称“长三角分中心”)和药品审评检查大湾区分中心(简称“大湾区分中心“)的建立、沟通交流内容的探索等。
自2020年12月挂牌以来,长三角分中心和大湾区分中心在一般性技术问题、药物研发与技术审评沟通交流、药品注册现场核查工作、行业座谈及培训等方面开展了大量工作,积累了一定经验。
申请人希望CDE与长三角分中心和大湾区分中心可以对已开展的工作进行梳理,将共性问题及其答复纳入常见问题,解答后在CDE网站专栏给予公示;同时对于分中心工作程序/工作内容在适当的时机公布,促进申请人对分中心工作情况/进展及未来计划有所了解,避免共性问题的反复出现,并帮助企业合理选择沟通交流路径。
CDE近期陆续开展了针对公司产品线的沟通交流申请。申请人希望CDE根据前期经验对开展此类沟通交流的目的、申请条件、申请材料及路径等以公告形式公示。在正式程序及指导原则公布前,可以允许申请人根据自身情况申请加入试点项目,进一步加强与CDE沟通交流,推进加快创新药品的研发。
综上所述,我国药品研发申请人与CDE之间的沟通交流,从无到有到好,得到了长足的发展和进步。面对与日俱增的沟通交流申请,CDE的沟通交流越来越专业、规范、完善和透明。
未来,希望CDE大幅增加审评资源配置,以便于在规定时限内回复申请人;加强对审评人员的能力建设以更好地应对日渐增多和复杂的沟通交流需求;同时,申请人的科学专业素养和沟通交流能力也要不断提高,以使得交流更加清晰顺畅;通过CDE早期介入、全程指导研发,进而实现科学审评决策流程,加快新药研发进程。
下期预告:
不断优化的药品注册现场核查
总第1607期















