(1)溶解性
羧基与水分子、乙醇分子可形成氢键,是一个亲水基。含碳原子数少的低级羧酸,如甲酸、乙酸等易溶于水,与水互溶。随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。高级脂肪酸是不溶于水的蜡状固体,如硬脂酸。
(2)熔、沸点
羧酸的沸点随碳原子数的增多而升高,低级酸一般是液态,高级酸往往是蜡状固体。且与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
练习:写出下列酸的名称:
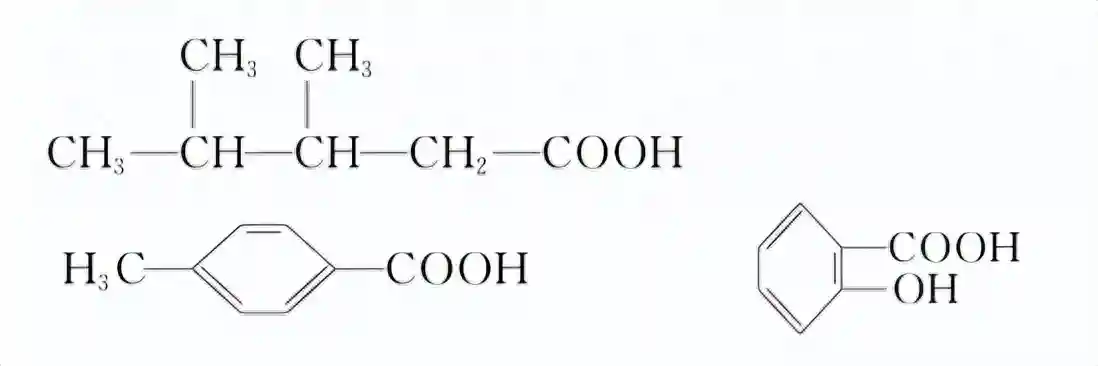
羧酸的命名与其它有机物类似,以羧基优先。选包含羧基的最长碳链作主链,按主链碳原子数称为某酸,芳香族的以苯环为主链;从羧基一端开始编号;如果有多个羧基用阿拉伯数字标明羧基的位置。
答案:3,4-二甲基戊酸、对甲基苯甲酸或4-甲基苯甲酸、邻羟基苯甲酸或2-羟基苯甲酸
许多羧酸有俗名,经常使用俗名,如上面的第三种酸叫水杨酸。
5、羧酸的化学性质羧酸的官能团是羧基,其化学性质主要取决于羧基。由于氧原子的电负性很大,使得O—H、C—O易断裂。。
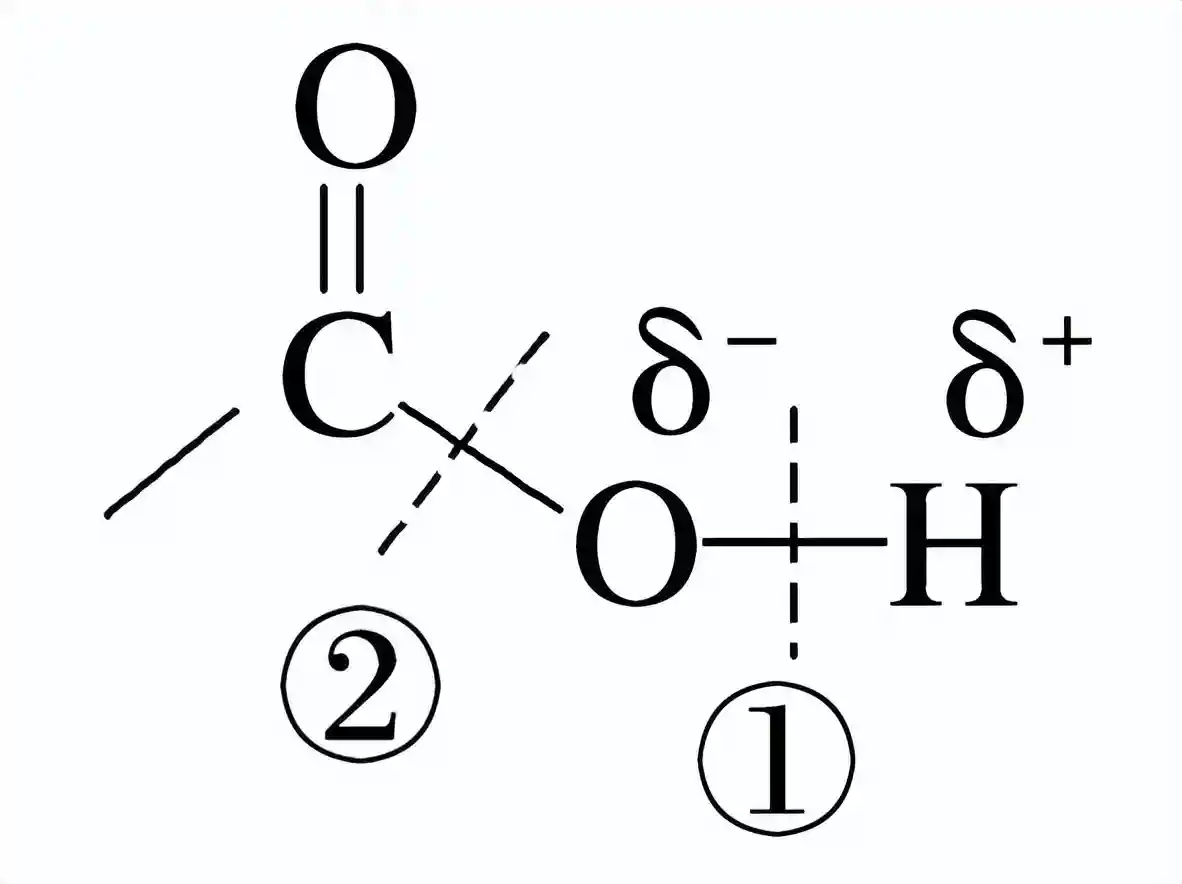
与乙酸相似,当O—H断裂时,会电离出,使羧酸表现出酸性;当C—O断裂时,—OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
(1)酸性
羧酸是一类弱酸,都能电离出氢离子,具有酸类的通性。
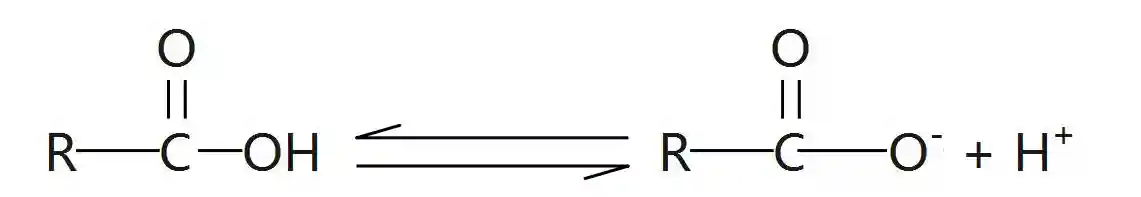
实验探究:
1)用实验证明甲酸、苯甲酸和乙二酸的酸性。
2)用实验比较乙酸、碳酸、苯酚的酸性强弱。
实验原理:
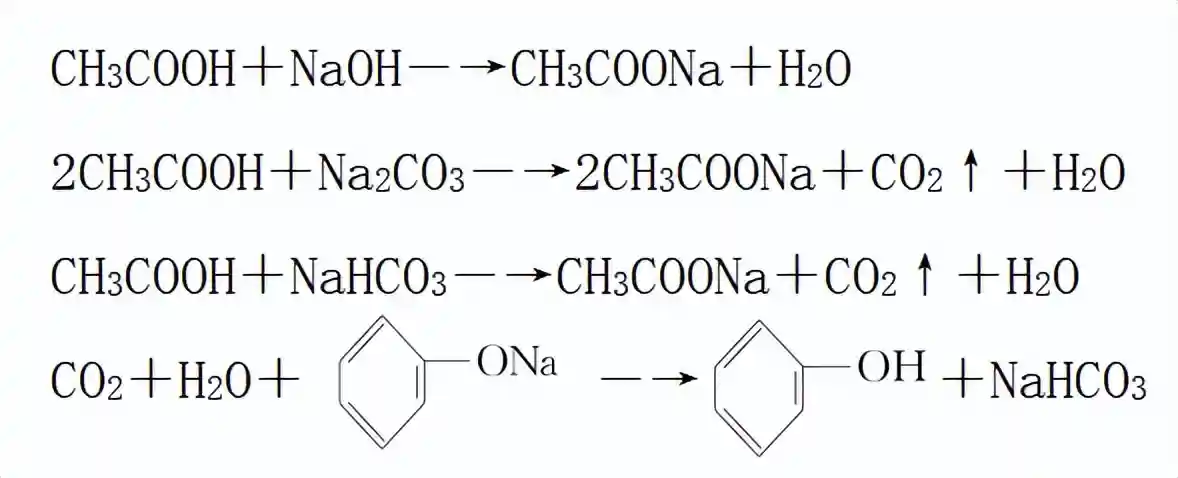
羧酸的酸性可以使用酸碱指示剂来检验,如使石蕊显红色;可以与碱(如NaOH)中和,但反应无明显现象,可配合酚酞等指示剂进行验证;也可用pH试纸或pH计测其溶液的酸碱度;还可以与碳酸钠、碳酸氢钠等反应生成二氧化碳气体来检验。
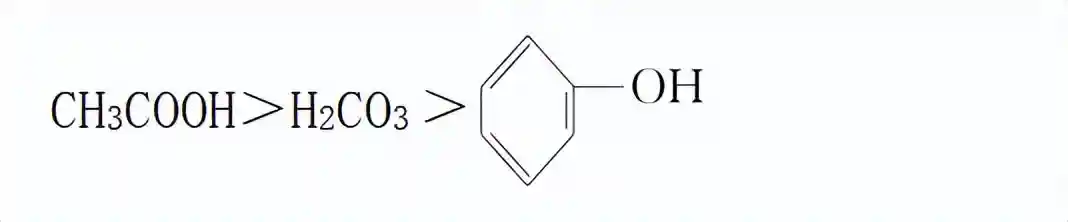
2)比较酸性强弱,可以利用强酸制弱酸的原理。乙酸与碳酸钠或碳酸氢钠反应生成二氧化碳,证明乙酸的酸性比碳酸强,再将二氧化碳通入苯酚钠溶液中生成苯酚,证明碳酸的酸性比苯酚强。
实验方案:
1)羧酸的酸性
取三支试管分别加入1/L的甲酸、苯甲酸、乙二酸溶液,再各滴入几滴紫色石蕊溶液。试管中的溶液均变红色。
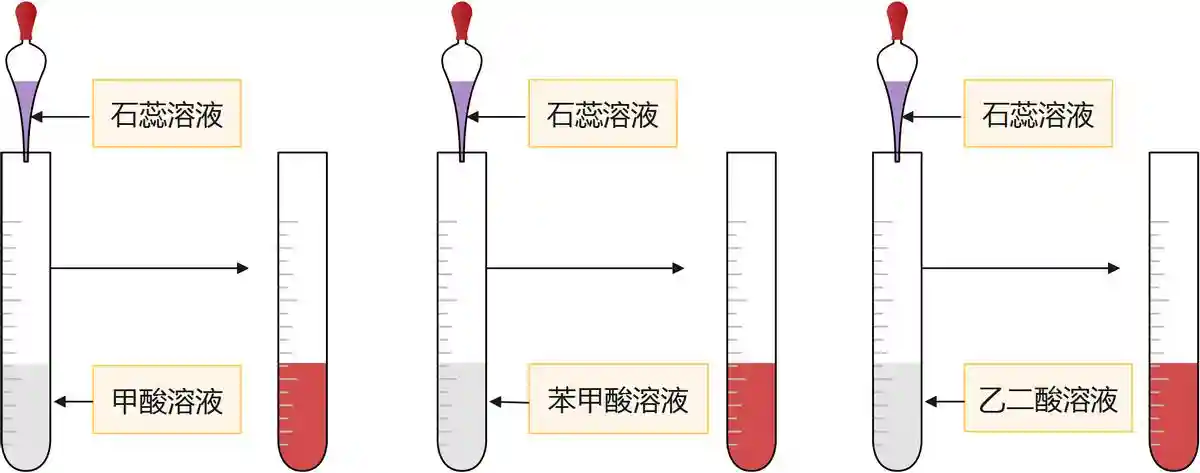
证明甲酸、苯甲酸和乙二酸均具有酸性。
2)利用下面的装置和试剂比较乙酸、碳酸、苯酚的酸性强弱
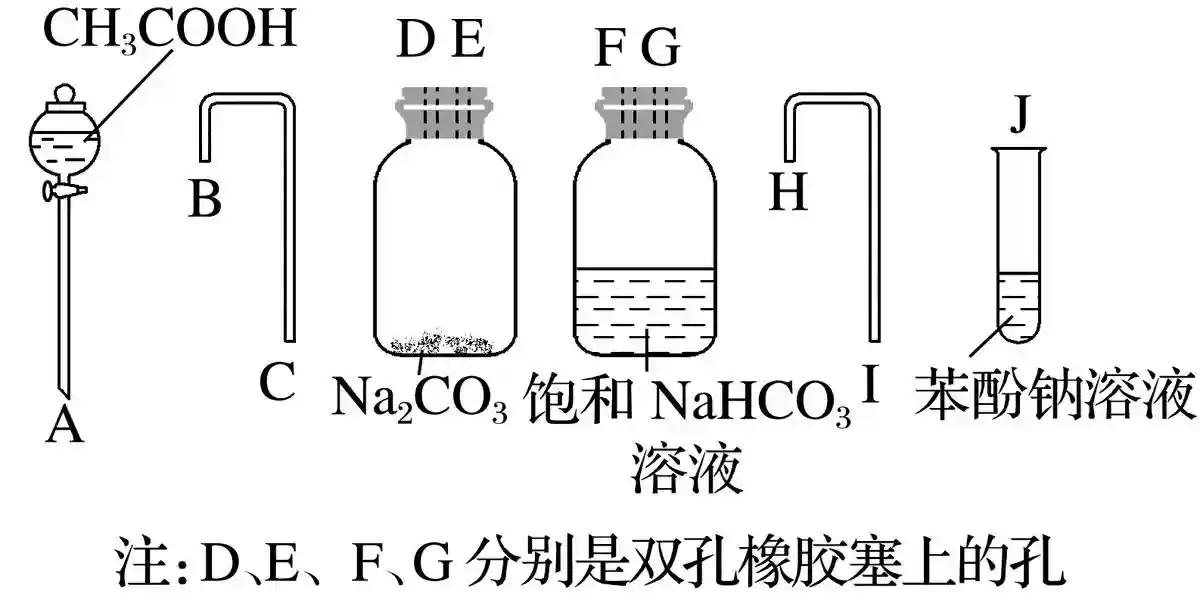
连接顺序:A→D、E→B、C→F、G→H、I→J(B、C与H、I可以颠倒,D与E、F与G也可以颠倒)。得到如下装置图:
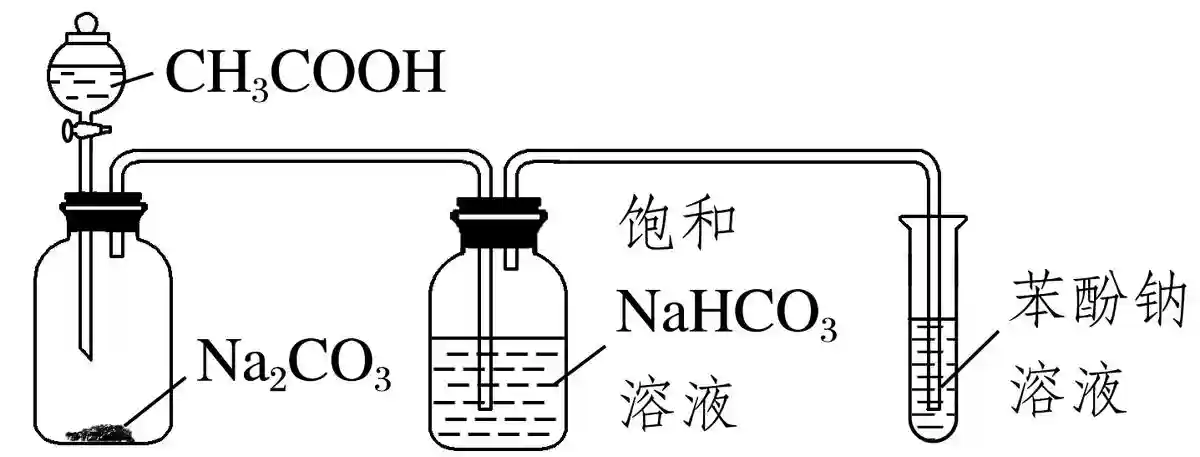
检查好装置的气密性后,加入相应的试剂,打开分液漏斗的活塞,放入乙酸,盛碳酸钠的广口瓶中产生气泡。用饱和碳酸氢钠溶液除去挥发出来的乙酸,防止其干扰实验。产生的二氧化碳通入苯酚钠溶液中,溶液变浑浊。
三种酸的酸性强弱:
羧酸是一类弱酸,具有酸类的通性质。如,能使紫色石蕊溶液变红色,与活泼金属反应置换氢气,与碱性氧化物、碱及某些盐反应。
(2)酯化反应(取代反应)
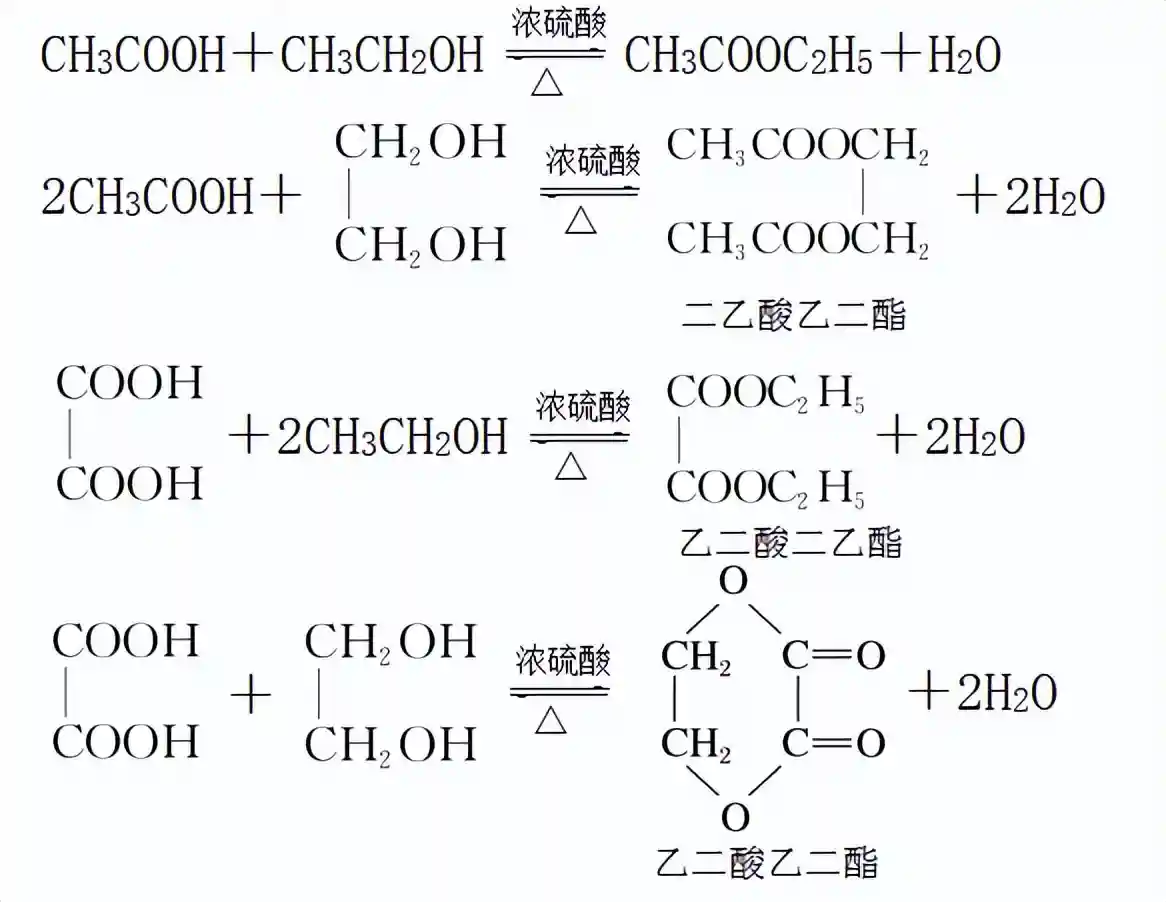
羧酸(包括一些无机含氧酸)和醇在酸的催化作用下可反应生成酯和水,叫酯化反应,属于取代反应。
使用同位素示踪法,酯化反应时,羧酸脱去羧基中的羟基,醇脱去羟基中的氢。
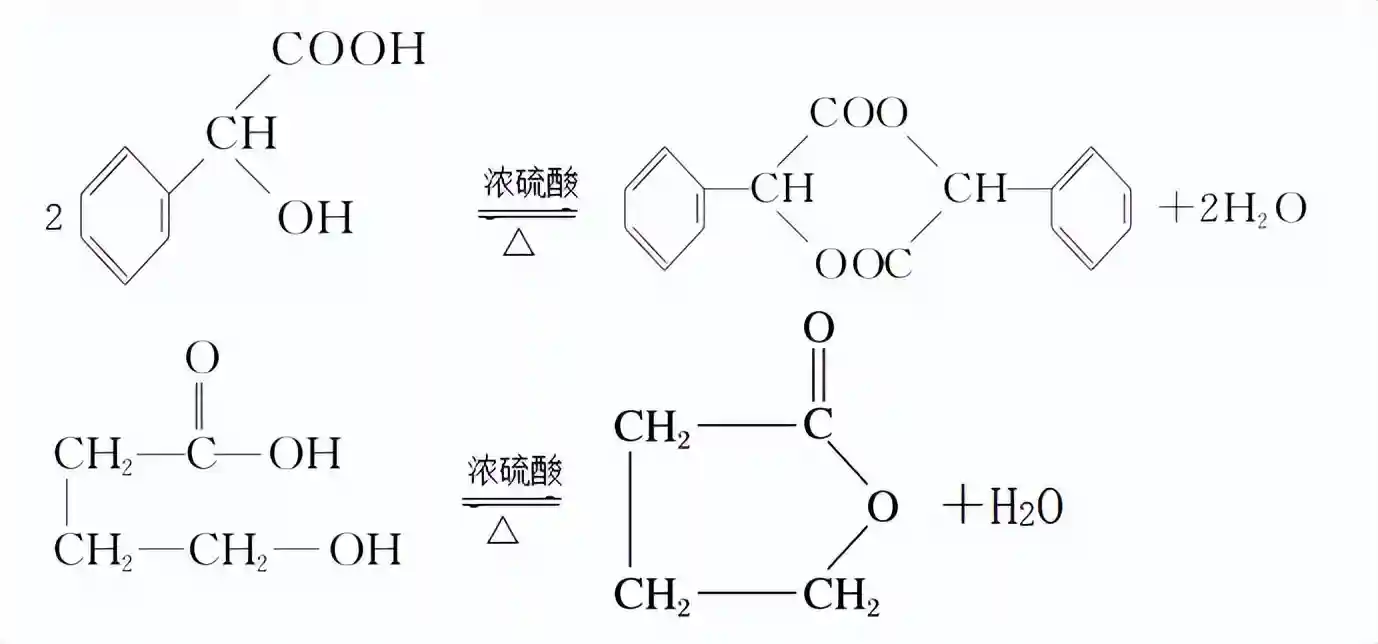
由于羧酸和醇的种类多样,酯化反应的类型也很多,反应发生时取代的方式也很灵活。如下面这些代表性的酯化反应。
练习:
某有机化合物M的结构简式为,按要求填空。
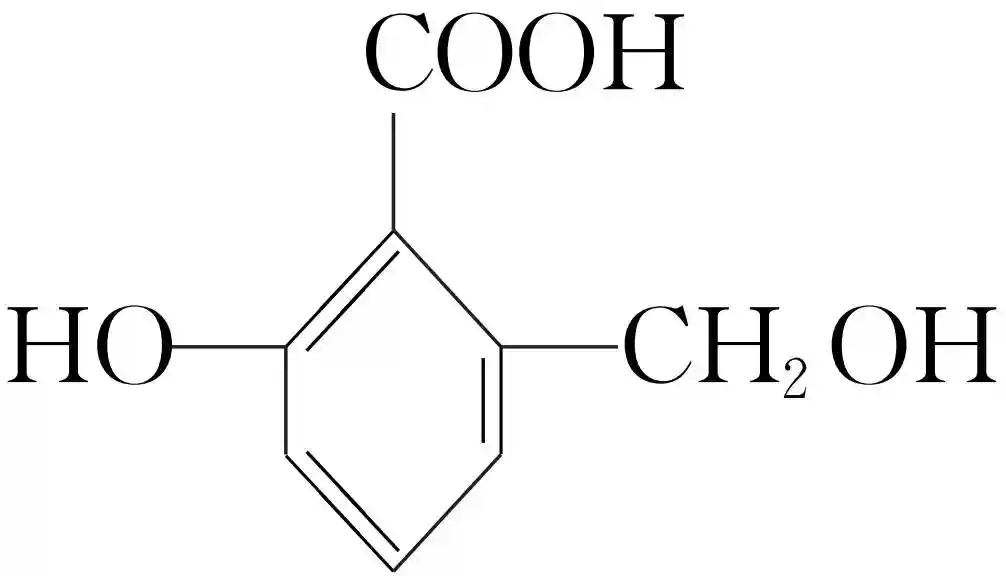
(1)写出M与Na,M与NaOH溶液反应的化学方程式:_____________________________。
(2)M与足量的Na2CO3反应生成的有机物的结构简式为__________________________。
(3)1molM最多消耗______molNaHCO3。
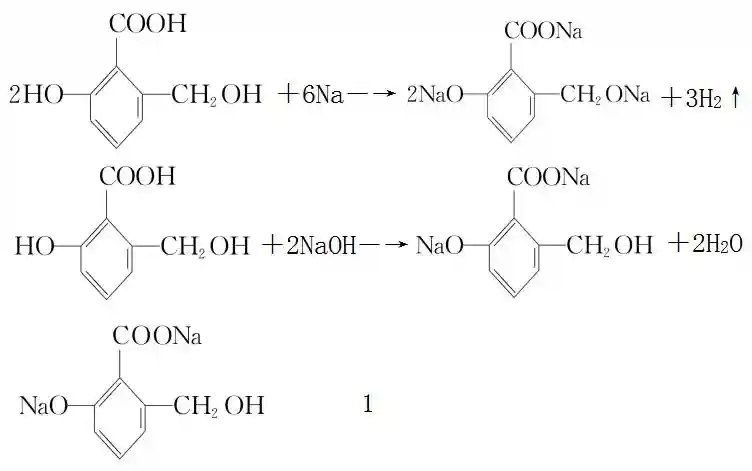
答案:
附:醇、酚、羧酸分子中羟基氢原子的活泼性
名称
醇
酚
羧酸
羟基氢原子的活泼性
不能电离
电离程度很小
电离程度相对较大
酸性
中性
极弱酸性
弱酸性
与Na反应
放出H2
放出H2
放出H2
与NaOH反应
不反应
反应
反应
与Na2CO3反应
不反应
反应
反应
与NaHCO3反应
不反应
不反应
反应
云水散人